联系我们
- 电话/微信:18520902353
- 客服QQ:3597831168
- 邮箱:info@wemaxnano.com
- 地址:广东省佛山市南海区狮山镇塘头名创钢材仓储园B区二楼
1.背景:
中风是世界范围内死亡和致残的主要原因,缺血性中风是最常见的中风类型。目前,旨在缓解症状的缺血性中风治疗无法实现神经再生和神经功能恢复;因此,迫切需要新的治疗策略。基于干细胞的治疗是通过营养支持或直接替换受损神经细胞来修复梗死组织和改善功能恢复的有前途的方法。然而,干细胞治疗缺血性中风的疗效在很大程度上受到限制,这是由于细胞向梗死区迁移不足、移植细胞死亡率高以及移植细胞与损伤脑组织的整合不良。
2. 研究亮点
在本研究中,用骨髓间充质干细胞(BMSCs)负载由电纺支架的纳米纤维和自适应可注射水凝胶组成的刚柔复合支架,并研究了这些负载的BMSCs对缺血性损伤的影响。对骨髓间充质干细胞的生存能力、迁移、轴突生长、血管生成能力和旁分泌作用的体外分析表明,复合支架中负载的骨髓基质干细胞比盐水中的骨髓基质细胞具有更好的治疗效果。此外,在体内,复合支架中负载的骨髓基质干细胞显著降低了脑水肿的程度和梗死体积,减轻了神经功能缺损,显著减弱了小胶质细胞和星形胶质细胞的过度激活,并增加了神经元增殖和血管生长。生物信息学分析显示,复合支架中负载的骨髓基质干细胞可以降低外泌体miR-206-3p的水平,从而增加PI3K/AKT信号通路的活性。
2.1复合支架的制备和表征:
将GC和DF-PEG混合以快速形成席夫碱键(图第1A段)。通过在液氮中研磨和高速粉碎制备纳米纤维(长度为100μm)(图1B)。然后,将负载有骨髓基质干细胞的复合支架(水凝胶和纳米纤维的混合物)经颅内施用到病变周围部位(图1C)。扫描电子显微镜(SEM)清楚地观察到水凝胶的互连多孔网络结构,大大增加了复合支架的表面积,增强了BMSCs的负载能力(图1D)。
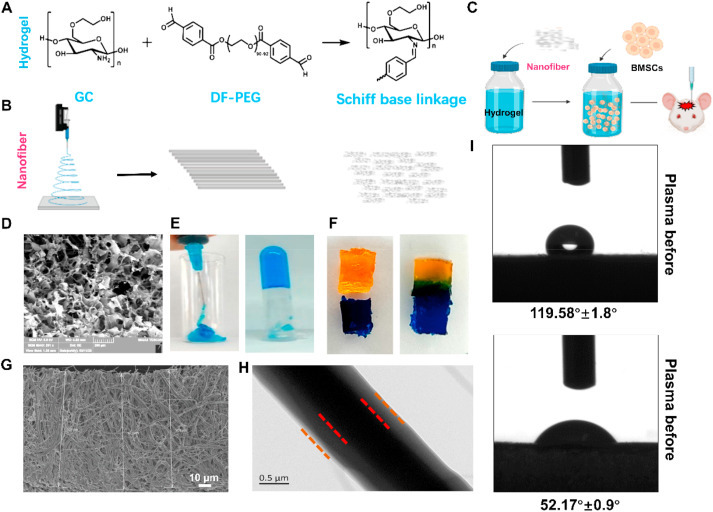
图 1. 水凝胶和纳米纤维的表征。(A) 通过在 GC 和 DF-PEG 之间形成动态席夫碱键制备水凝胶。(B) 纳米纤维是通过液氮研磨和高速粉碎制备的。(C) 将 BMSC 装载到复合支架中用于脑缺血治疗的程序。(D) 水凝胶的 SEM 图像。(E) 水凝胶的可注射性和 (F) 自适应特性。(G) 100 μm 长度的纳米纤维的 SEM 图像。(H) 以核壳纳米结构为特征的纳米纤维的 TEM 图像。(I)核壳纤维与水介质之间的示意图。
2.2装载在复合支架中的骨髓基质干细胞的治疗效果
通过伤口愈合试验评估迁移能力。条件培养基(CM)是从培养的BMSC和支架负载的BMSC中获得的。结果表明,与用BMSCs+CM培养的BMSCs相比,用BMSCs+支架培养的BMSC表现出更好的迁移能力(图2A和B;p<0.05)。此外,在正常和OGD条件下,复合支架组中的BMSC显示出更高的生存能力(图2C;p<0.001)和更强的旁分泌作用(BDNF和VEGF),表明支架负载的BMSC分别在神经保护和促血管生成方面具有优越的治疗潜力,尽管在正常或OGD条件下IGF-1水平没有显著差异(图2D,E,3F;p<0.001)。
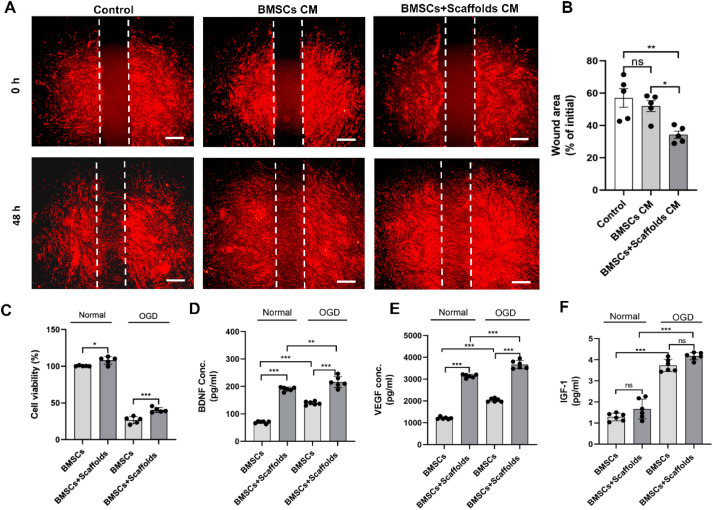
图2.负载支架的BMSC表现出更强的生物学效应。在正常和 OGD 条件下,悬浮的 BMSC 和 BMSC + 支架衍生的 CM 对 BMSC 迁移(A 和 B)和 BMSC 活力(C)的影响。(D–F) 正常和 OGD 条件下 BMSCs- 和 BMSCs + Scaffolds-CM 中旁分泌因子的浓度。数据以平均值±SEM 表示。学生 t 检验用于分析 D-F 中的数据,而单向方差分析和 Tukey 事后检验用于分析 B 和 C 中的数据。*p < 0.05;**p < 0.01;**p < 0.001;ns,不显着。
2.3复合支架改善了骨髓基质干细胞在大脑中的滞留
移植后,在MCAO+BMSCs+支架组中观察到比MCAO+BMS组更强的BMSCs生物发光,并且即使在14天时,在MCAO+BMSCs+支架组也有清晰的生物发光信号。这一结果表明,复合支架可以改善骨髓基质干细胞在大脑中的保留(图3第A和B段)。
此外,MCAO+BMSCs组中RFP阳性细胞的数量迅速减少。相反,负载在复合支架中的骨髓基质干细胞不仅保持了强的RFP信号,而且倾向于分散,这表明这些细胞可以动态迁移到大脑的损伤区域(图3第C段)。
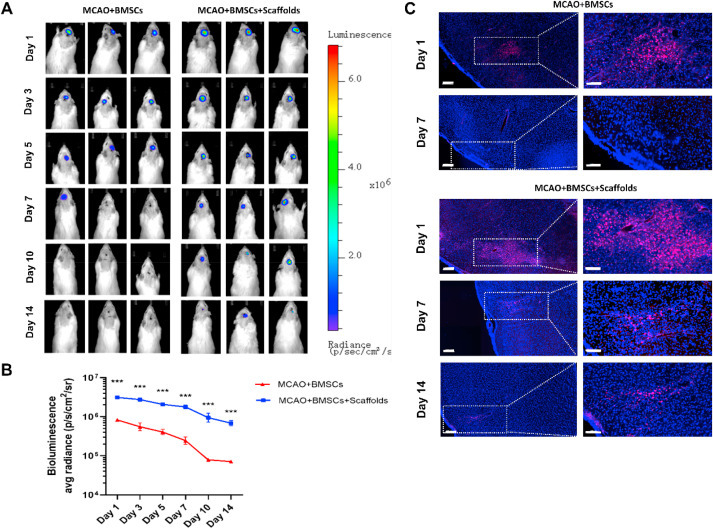
图 3. 装载在复合支架中的 BMSC 在大脑中表现出长时间的保留。(A)和(B)通过IVIS成像评估各组BMSC的脑保留情况。获得MCAO大鼠中BMSC和支架负载BMSC在第1天、3天、5天、7天、10天和14天时的IVIS图像。(C)测定MCAO大鼠中移植的BMSC或负载支架的BMSC(稳定表达RFP)的生物发光信号强度;比例尺 = 200 μm(左)和 100 μm(右)。复合支架中加载的BMSCs的保留期比盐水组的BMSCs的保留期长得多。数据以平均值±SEM 表示。学生 t 检验用于确定 p 值。相对于 MCAO + BMSC 组,**p < 0.001。
2.4复合支架中负载的骨髓基质干细胞减轻了缺血性损伤
在动物中有一个方案来评估支架负载的BMSC的治疗潜力(图4A)。MCAO后第7天,与MCAO+BMSCs组相比,MCAO+BMS组在MCAO后3天的梗死面积显著减少(图4B和C;p<0.01),脑水肿减轻(图4D;p<0.01)。此外,在MCAO后7天和14天,与MCAO+BMSCs组相比,用复合支架中负载的BMSCs治疗的动物的神经缺陷显著改善(图4E、F和6G)。
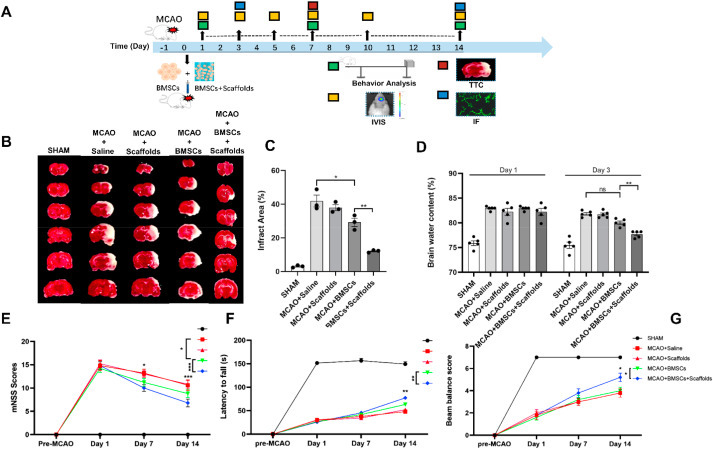
图 4. 复合支架中装载的 BMSC 可改善缺血性中风。(A) 体内实验方案。(B、C) 通过 TTC 染色评估 BMSC 和负载支架的 BMSC 的作用。(D) MCAO 后 1 天和 3 天的脑含水量。MCAO 模型大鼠的运动功能恢复通过 (E) mNSS 评分、旋转测试 (F) 和梁平衡分析 (G) 进行评估。数据以平均值±SEM 表示。对于 C-G,所有 p 值均通过单向方差分析和 Tukey 事后检验确定。*p<0.05;**p < 0.01;**p < 0.001;ns,不显着。
2.5 装载复合支架的 BMSC 中 miR-206–3p 的较低表达增强了 PI3K/AKT 信号通路的活性
如图5G和H所示,p-PI3K/p-AKT及其下游蛋白VEGFR2和VEGFA的表达在miR-206–3p antagomir处理后上调(MCAO + BMSCs组),而在miR-206–3p处理后下调 agomir 治疗(MCAO + BMSCs + 支架组)。相反,裂解的caspase-3则表现出相反的趋势。这些结果表明 miR-206–3p 可以负向调节 PI3K/AKT 信号通路蛋白的表达和 PI3K/AKT 信号通路的活性。因此,支架负载的 BMSC 的神经保护和血管生成作用可能至少部分是通过抑制 miR-206-3p 表达和增强 PI3K/AKT 信号通路活性来介导的。
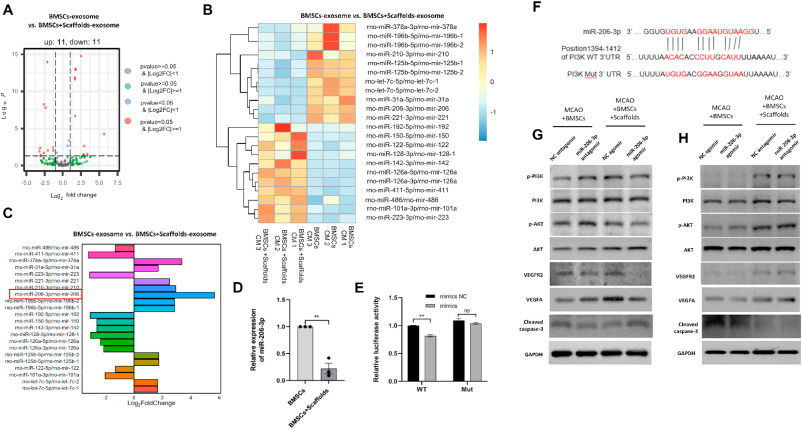
图 5. BMSCs + 支架来源的外泌体中 miR-206–3p 的较低表达通过抑制 PI3K 的降解来改善缺血性中风。(A–C) 火山图、热图和柱图显示 BMSCs-外泌体组和 BMSCs + 支架-外泌体组之间差异表达的 miRNA。(D) 通过 RT-PCR 验证了两组外泌体之间的差异 miR-206–3p 表达。(E, F) miR-206–3p 和 PI3K 基因之间的结合位点由 miRWalk 数据库预测并通过双荧光素酶报告基因测定验证。(G,H)Western印迹分析用于验证转染miR-206–3p agomir或antagomir后MCAO + BMSCs组和MCAO + BMSCs + Scaffolds组之间的差异蛋白表达。数据以平均值±SEM 表示。使用学生 t 检验来分析 (D) 中的数据,而使用 Tukey 事后检验的单向方差分析来分析 E 中的数据。**p < 0.01;ns,不显着。
结论:
总之,本研究报道了负载在新型纳米纤维/水凝胶复合支架中的骨髓基质干细胞对缺血性损伤后脑损伤的保护作用。这些负载BMSC的复合支架可能通过调节miR-206–3p对PI3K/AKT信号通路的抑制作用来发挥其作用。由于其增强半影血管生成和神经再生的能力,BMSCs/纳米纤维/水凝胶复合支架系统可能是缺血性脑损伤临床治疗的潜在治疗策略。
原文链接:
https://doi.org/10.1016/j.mtadv.2023.100349